- Фибринолизин
- Код по АТХ
- Действующие вещества
- Фармакологическая группа
- Фармакологическое действие
- Показания к применению Фибринолизина
- Форма выпуска
- Фармакодинамика
- Использование Фибринолизина во время беременности
- Противопоказания
- Побочные действия Фибринолизина
- Способ применения и дозы
- Гемостатические средства
Фибринолизин
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Фибринолизин оказывает в отношении человеческой крови противосвертывающее влияние.
Медикамент предотвращает процессы кровосвёртывания. Он обладает способностью к расщеплению фибриновых белковых нитей – оказывает влияние, схожее с действием протеолитического энзима. Наиболее эффективным Фибринолизин является в случае его применения на начальном этапе – сразу при возникновении сгустков фибрина и тромбообразовании. Далее терапевтическая эффективность ослабляется в соответствии с продолжительностью наличия тромба.

Код по АТХ
Действующие вещества
Фармакологическая группа
Фармакологическое действие
Показания к применению Фибринолизина
Средство во флаконах применяется при таких расстройствах:
- тромбоэмболия, поражающая легочные или периферические артерии;
- тромбофлебит в активной фазе;
- затрагивающая мозговые сосуды тромбоэмболия;
- обострившийся тромбофлебит, имеющий хронический характер;
- инфаркт миокарда.
Использование ЛС в ампулах:
- кровоизлияния в область зрительных органов, имеющие травматическое происхождение (минимум спустя 4 суток от времени получения внутриглазного повреждения);
- кровоизлияния, поражающие стекловидное тело, а вместе с тем сетчатку или же переднюю зону глазной камеры;
- поражающий центральные сосуды, расположенные внутри глаза (артерии либо вены), вместе с их ветвями, тромбоз.

Форма выпуска
Выпуск элемента реализуется в виде инъекционного лиофилизата – внутри флакончиков ёмкостью 20 000 ЕД (1 штука) либо ампул объёмом 300 ЕД (10 штук).

Фармакодинамика
Фибринолизин – это плазменный элемент крови человека, вырабатываемый при помощи трипсина, который через энзимы активирует внутриплазменный профибринолизин.
Терапевтическое влияние фибринолизина определяется биологическим методом установления того, как он выполняет лизис обычного свежего фибринового сгустка в условиях температуры, составляющей 37°C, в течение получаса, и обозначается в ЕД.

Использование Фибринолизина во время беременности
Запрещено вводить медикамент при беременности либо ГВ.

Противопоказания
Среди противопоказаний средства во флакончиках:
- диатезы геморрагического характера;
- острая фаза гепатита;
- раны открытого характера;
- фибриногенопения;
- увеличенная чувствительность;
- кровотечения;
- печеночный цирроз;
- лучевая болезнь;
- язва, поражающая зону ЖКТ;
- нефрит;
- легочный туберкулёз в активной фазе;
- имеющиеся в анамнезе анафилактические проявления;
- недавно перенесённая (в пределах 10-ти дней) биопсия, операция, пункция в области крупных сосудов или травма;
- очень высокие показатели АД, сопровождающие поражения мозга.
Противопоказания для ЛС в ампулах:
- сильная непереносимость медикаментозного средства;
- имеющиеся в анамнезе анафилактические симптомы;
- противопоказания относительно дикаина, потому как его вводят перед использованием Фибринолизина.

Побочные действия Фибринолизина
Среди побочных признаков лекарства во флаконах:
- симптомы аллергии (среди них лихорадочное состояние, лицевая гиперемия и крапивница);
- понижение показателей АД (требуется следить за давлением при использовании ЛС);
- боли, поражающие абдоминальную зону или грудину;
- кровотечения;
- боль или иные изменения в зоне укола.
При использовании ампул:
- признаки аллергии (крапивница, лицевая гиперемия или локальная отёчность);
- боль либо изменения в области инъекции.
В случае появления таких нарушений нужно уменьшить скорость инъекции, а при развитии выраженных проявлений введение прекращают. Чтобы устранить отрицательные симптомы, применяют антигистаминные или сердечнососудистые ЛС и промедол (выбирают с учётом направленности расстройств).

Способ применения и дозы
Использование медикамента из флакончиков.
В случае инфаркта миокарда или тромбоза мозговых сосудов необходимо вводить лекарство в период начальных 6-ти часов. При тромбозе, который поражает периферические артерии, требуется инфузия в начальные 12 часов. Во время тромбоза, связанного с периферическими венами, делать укол необходимо в период 5-7-ми дней с момента обнаружения тромбоза.
Препарат применяется в форме инфузий. Перед процедурой инфузии порошок из флакончика растворяют в 9%-ном NaCl в пропорции 100-160 ЕД/мл. Затем к получившемуся раствору прибавляют гепарин в соотношении гепарин 10000 ЕД на фибринолизин 20000 ЕД. Сначала инфузия выполняется на скорости 10-12 капель/минута. Можно также повышать скорость до 15-20-ти капель/минута (если наблюдается хорошая переносимость). Общий размер порции за день колеблется в диапазоне 20000-40000 ЕД, с продолжительностью процедуры минимум 3 часа. Необходимо учитывать, что Фибринолизин не содержит стабилизатора, в связи с чем готовая жидкость быстро утрачивает свою медикаментозную активность.
По завершении инфузии препарата вместе с гепарином нужно проводить внутримышечное либо внутривенное введение только гепарина в порции 40000-60000 ЕД/сутки в пределах 2-3-х дней. При этом его доза постепенно уменьшается, а далее происходит переход на введение непрямых антикоагулянтов.
Введение медикамента в ампулах.
Порцию лекарства, составляющую 300 ЕД, применяют только субконъюнктивальным способом. Перед выполнением процедуры вещество из 1-ой ампулы растворяют в инъекционной жидкости (0,5 мл). Готовое вещество вкалывают под конъюнктиву в области склеры либо расположенной снизу переходной складки (перед этим также нужно выполнить введение 0,5%-ного дикаина в область конъюнктивального мешка – в качестве анестезии).
Выполнять повторные уколы необходимо по истечении 1-2-х суток. Суммарное число уколов варьирует в границах 3-10-ти, с учётом существующих показаний.

Гемостатические средства
Гемостатические средства — лекарственные средства, способствующие остановке кровотечений. Все гемостатики, в зависимости от механизма действия, подразделяются на три большие группы:
- ингибиторы фибринолиза (антифибринолитики);
- средства, усиливающие свертывание крови (коагулянты);
- средства, понижающие сосудистую проницаемость.
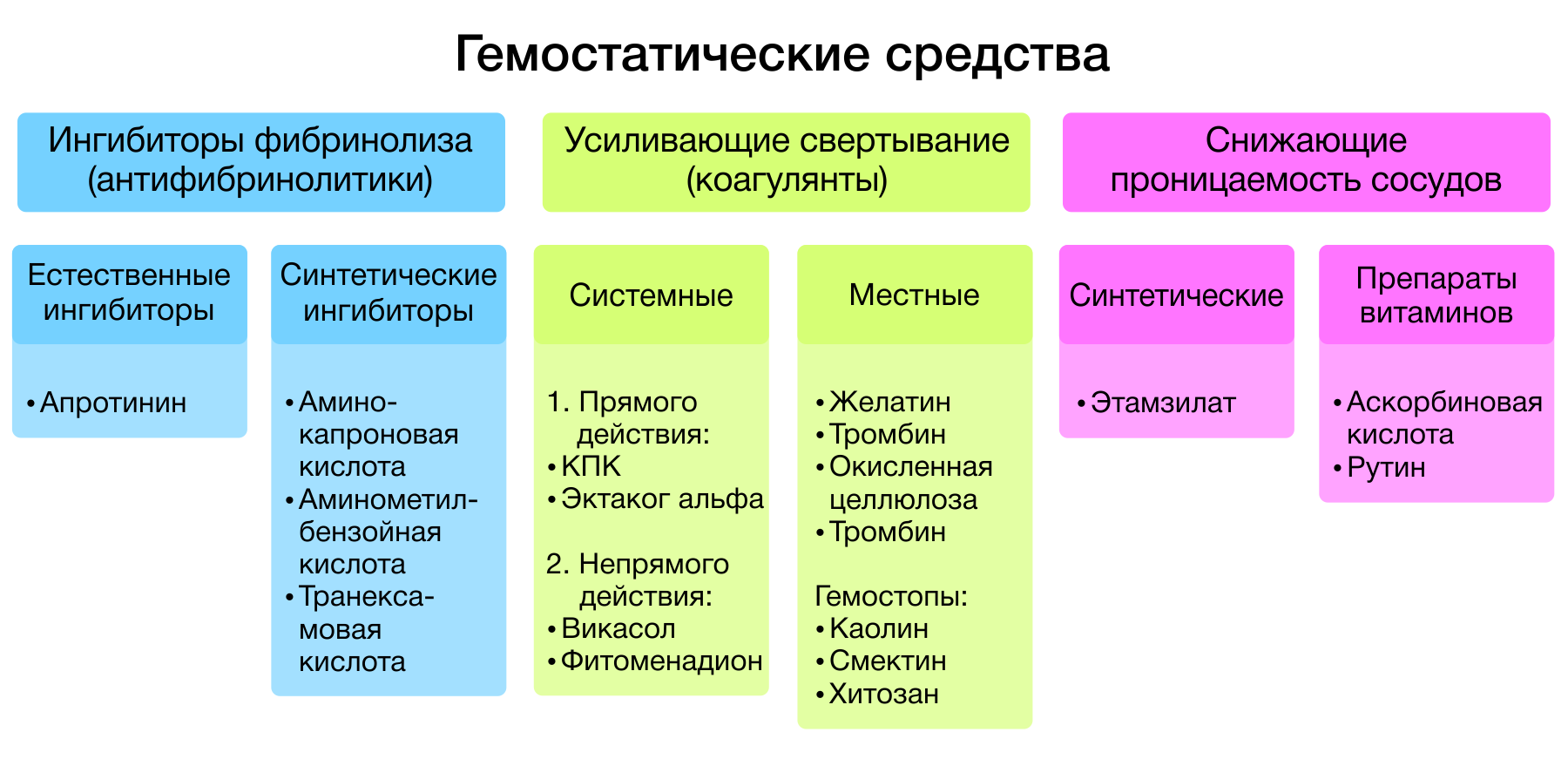
Рисунок 1 | Классификация гемостатиков.
1. Ингибиторы фибринолиза.
В клинической практике широкое распространение получили две группы препаратов ингибиторов фибринолиза: естественные ингибиторы фибринолиза (апротинин и его аналоги) и синтетические ингибиторы фибринолиза (аминокапроновая кислота, аминометилбензойная кислота, транексамовая кислота).
Апротинин — полипептид, получаемый из легких, поджелудочной и околоушной желез крупного рогатого скота, действующий аналогично α2-антиплазмину. Апротинин разрушает свободный плазмин, практически не взаимодействует со связанным плазмином, а также угнетает активацию тромбоцитов. Являясь сериновой протеазой, апротинин блокирует калликреин-кининовую систему путем разрушения калликреина, снижает активность отдельных протеолитических ферментов, таких как: трипсин, химотрипсин, кининогеназа. Изначально препарат был включен в рекомендации по лечению острого панкреатита и панкреонекроза, однако не подтвердил свою эффективность, и показания к его применению были пересмотрены.[1]
Аминокапроновая кислота – 6-аминогексановая кислота — синтетическое производное лизина. Присоединяясь к лизин-связывающему участку плазминогена, аминокапроновая кислота обратимо блокирует процесс фибринолиза, снижает активность стрептокиназы, урокиназы, тканевых киназ, калликреина, трипсина и гиалуронидазы. Аналогичным фармакологическим эффектом обладает производное аминокапроновой кислоты — аминометилбензойная кислота, отличающаяся улучшенной фармакокинетикой. Аминокапроновая кислота снижает активность тромболитических препаратов и может быть использована для нейтрализации их эффекта.
Транексамовая кислота — транс-4-(аминометил)-циклогексанкарбоновая кислота — обратимо блокирует эффект плазминогена, адгезию лейкоцитов и тромбоцитов на поверхность тромба за счет конкурентного ингибирования активатора плазминогена. Оказывает противоаллергическое и противовоспалительное действие посредством подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. По мощности антифибринолитического действия транексамовая кислота значительно превосходит аминокапроновую кислоту. Активность препарата в плазме сохраняется на протяжении 7-8 часов, в тканях — до 17 часов.[2]
У больных с высоким риском массивной кровопотери в плановой хирургии (сердечно-сосудистая хирургия, травматология и ортопедия, трансплантология) применение ингибиторов фибринолиза уменьшает интраоперационную кровопотерю и снижает потребность в трансфузии донорской крови. На протяжении 20 лет проводилось множество исследований, результаты которых были неоднозначны: мнения склонялись то в пользу апротинина, то в пользу синтетических производных лизина.
В 2007 году компания Bayer завершила исследование BART (Blood conservation using antifibrinolytics in a randomized trial), в котором было изучено действие апротинина у кардиохирургических больных высокого риска. Исследователи выявили большой риск летальных исходов и осложнений при использовании апротинина. В группе апротинина количество больных с массивной кровопотерей было несколько меньше, но 30-дневная летальность на 50% превышала аналогичный показатель в других группах.[3]
После публикации результатов BART компания Bayer уведомила Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) о намерении изъять апротинин с рынка. Показания к назначению были пересмотрены, и препарат был исключен из списка безопасных лекарственных средств.
Огромный мета-анализ позволил сделать вывод, что транексамовая кислота обеспечивает такое же снижение периоперационной трансфузии, какое наблюдается при использовании апротинина, но более безопасна. Согласно рекомендациям Европейского общества анестезиологов по ведению пациентов с массивной периоперационной кровопотерей (2013 г.), при массивном кровотечении рекомендуется применение транексамовой кислоты (20-25 мг/кг); она может быть введена повторно или применяться в виде пролонгированной инфузии (1-2 мг/кг/ч).[4]
2. Препараты, усиливающие свертывание крови
Среди средств, повышающих скорость свертывания крови, выделяют: средства системного действия и для местного применения. К препаратам системного действия относят непрямые коагулянты (фитоменадион, менадиона натрия бисульфит) и коагулянты прямого действия (факторы свертывания: концентрат протромбинового комплекса, эптаког альфа).
Менадиона натрия бисульфит — синтетический водорастворимый аналог витамина К3. Субстратно стимулирует витамин K-редуктазу, активирующую витамин К и обеспечивающую его участие в печеночном синтезе витамин K-зависимых плазменных факторов гемостаза (II, VII, IX, X). Фитоменадион является синтетическим структурным аналогом витамина К1, обладает большей активностью и более ранним началом реализации эффектов (через 6-10 часов после перорального применения, против 18-24 часов у менадиона натрия бисульфита). Данная группа препаратов показана для коррекции нарушений системы гемостаза, вызванных дефицитом витамина К1, передозировкой антикоагулянтов непрямого действия (варфарина), а также для предоперационной профилактики кровотечений.
Концентрат протромбинового комплекса (КПК) — лекарственный препарат, содержащий факторы II, VII, IX, X, а также следовые концентрации антитромбина III, гепарина, протеинов С и S. Основным показанием к применению КПК служит коррекция приобретенного дефицита витамин К1-зависимых факторов в экстренных ситуациях (кровотечение, экстренная операция). Помимо этого, КПК широко используется как средство для лечения и профилактики кровотечений у пациентов с врожденным дефицитом одного из К1 зависимых факторов свертывания (врожденная гипопротромбинемия, врожденный дефицит фактора Стюарта – Прауэра).[5]
Эптаког альфа — рекомбинантный активированный VII фактор свертывания. Механизм действия препарата заключается в прямой активации фактора Х на поверхности активированных тромбоцитов. Это вызывает «тромбиновый взрыв» независимо от имеющейся концентрации факторов VIIIa и IXa. В результате образуется стабильный фибриновый сгусток. Считается, что эптаког альфа инициирует гемостаз только в месте повреждения ткани и не вызывает системной активации механизмов свертывания. Препарат был разработан для лечения кровотечений и проведения хирургических вмешательств у пациентов с наследственной или приобретенной гемофилией и высоким титром ингибитора факторов свертывания VIIIa или IXa. Его применение у пациентов с массивным кровотечением можно сформулировать согласно рекомендациям ESA (2013): «Применение рекомбинантного фактора VII возможно только при кровотечениях, которые не могут быть устранены хирургическими методами или путем комплексной гемостаз-корригирующей терапии». Необходимо серьезное обоснование для применения данного препарата [6].
3. Местные гемостатики
Местные гемостатики используются для остановки капиллярных и паренхиматозных кровотечений преимущественно в неотложной хирургии и стоматологии. Данная группа включает в себя широкий спектр препаратов с различным механизмом действия.
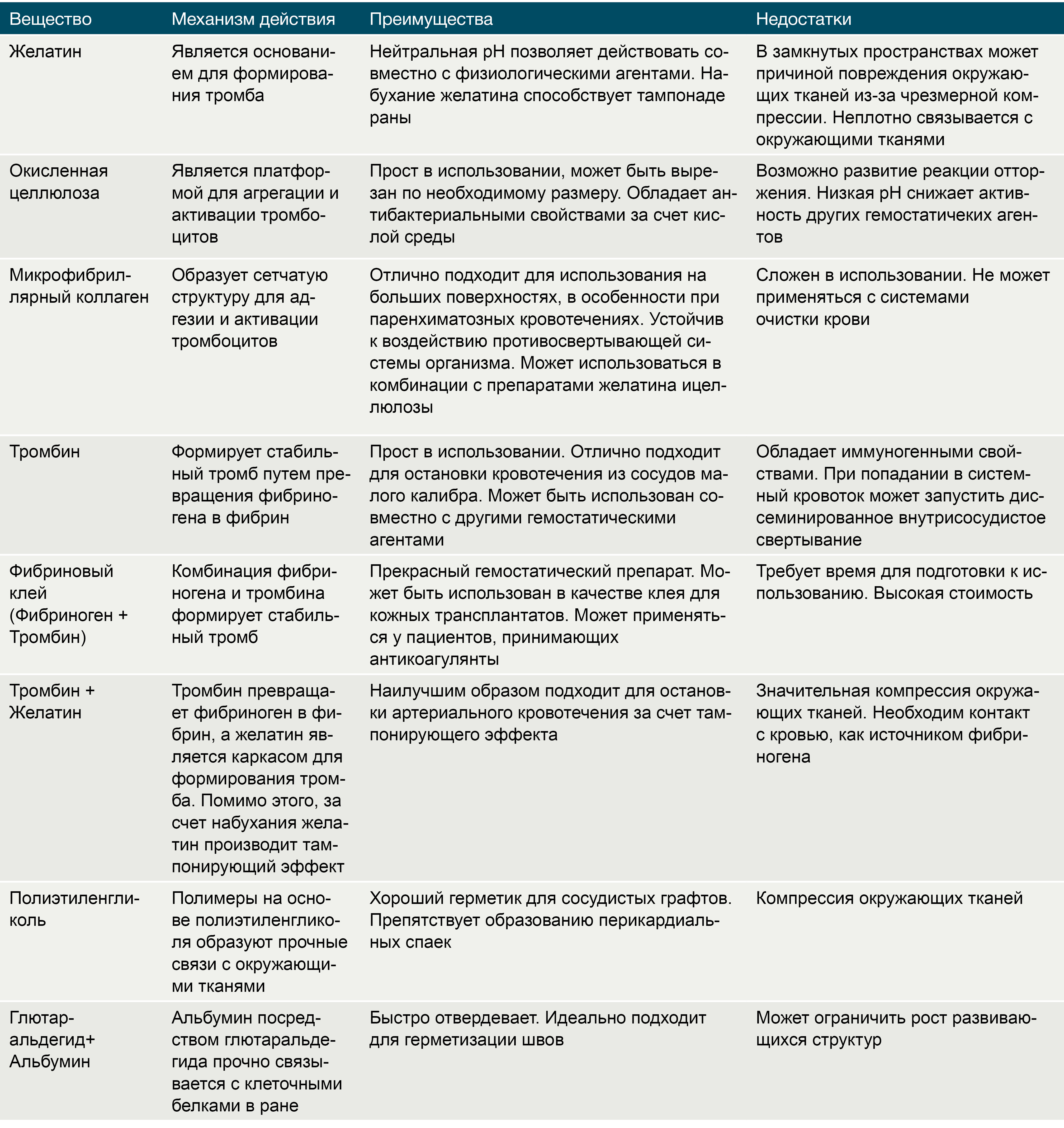
Препараты на основе желатина, получаемого из свиной кожи, существуют в трех формах: пленка, губка и порошок. Желатин чрезвычайно гигроскопичен, и за счет этого свойства он абсорбирует влагу, увеличиваясь в размерах и заполняя тканевой дефект. Существуют комбинации желатина с тромбином, которые помимо пассивного гемостатического эффекта напрямую запускают коагуляционный каскад и активируют тромбоциты в месте нанесения. Желатин разрушается протеиназами в течение 4-6 недель. Несмотря на абсолютную индифферентность, желатин может служить в качестве хронического очага инфекции. Помимо этого, одним из существенных недостатков данных препаратов является отсутствие прочных связей с окружающими тканями [7].
Тромбин является естественным компонентом свертывающей системы крови. Раствор тромбина используют только местно при капиллярных или паренхиматозных кровотечениях в ходе нейрохирургических вмешательств, операций на печени и почках, в стоматологической практике. Попадание тромбина в крупные кровеносные сосуды может вызвать распространенный тромбоз [7].
Окисленная целлюлоза выпускается в виде пленок, сеток, пучков и губок. Данный биологический агент играет роль субстрата для агрегации тромбоцитов и активации механизмов гемостаза. Целлюлоза значительно снижает рН среды, что приводит к лизису эритроцитов с образованием кислого гематина, который формирует дополнительный искусственный сгусток. Помимо этого окисленная целлюлоза обладает антибактериальным эффектом, в том числе в отношении антибиотикорезистентных микроорганизмов [7].
Микрофибриллярный коллаген, производимый из кожи крупного рогатого скота, имеет ряд преимуществ перед остальными топическими биологическими кровоостанавливающими агентами, среди которых: быстрый гемостатический эффект, минимальная реактивность тканей и высокая способность к реабсорбции. Аналогично целлюлозе, микрофибриллярный коллаген является матрицей для активации тромбоцитов, агрегации и образования тромбов [7].
Подвидом местных кровоостанавливающих средств являются гемостопы, получившие большое распространение в военной медицине. Это препараты внешнего воздействия, которые почти не влияют на свертывающую и противосвертывающую системы крови. Многообразие форм выпуска обеспечивает удобство применения в полевых условиях и полностью удовлетворяет потребностям оказания неотложной помощи при любых кровотечениях. На сегодняшний день наиболее эффективным средством считается хитозан.
Хитозан – это полисахаридный биополимер, получаемый из хитиновых панцирей ракообразных. Кровоостанавливающий эффект данного вещества достигается путем связывания хлопьев хитозана с отрицательно-заряженными эритроцитами и образования гелеобразного сгустка в месте контакта с кровью. Среди преимуществ препаратов на основе хитозана выделяют его антимикробные свойства, длительный срок хранения, стабильность при перепадах температур и безопасность при наружном использовании [8].
Наиболее известным представителем группы средств, понижающих сосудистую проницаемость, является этамзилат. Гемостатический эффект данного препарата обусловлен активацией тромбопластина в месте повреждения сосудов микроциркуляторного русла и снижением синтеза простациклина PGI-2 в эндотелии сосудов, что в конечном итоге приводит к усилению адгезии и агрегации тромбоцитов, остановке или уменьшению кровоточивости. За счет антигиалуронидазного действия этамзилат обладает ангиопротективным эффектом, улучшает микроциркуляцию и нормализует проницаемость сосудистой стенки при патологических процессах [9].
Источники
- Fergusson D. A. et al. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery //New England Journal of Medicine. – 2008. – Т. 358. – №. 22. – С. 2319-2331.
- Williams-Johnson J. A. et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial //West Indian Medical Journal. – 2010. – Т. 59. – №. 6. – С. 612-624.
- Ferraris V. A. et al. Perioperative blood transfusion and blood conservation in cardiac surgery: the Society of Thoracic Surgeons and The Society of Cardiovascular Anesthesiologists clinical practice guideline //The Annals of thoracic surgery. – 2007. – Т. 83. – №. 5. – С. S27-S86.
- Sedrakyan A., Treasure T., Elefteriades J. A. Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a systematic review and meta-analysis of randomized clinical trials //The Journal of thoracic and cardiovascular surgery. – 2004. – Т. 128. – №. 3. – С. 442-448.
- Song H. K. et al. Safety and efficacy of prothrombin complex concentrates for the treatment of coagulopathy after cardiac surgery //The Journal of thoracic and cardiovascular surgery. – 2014. – Т. 147. – №. 3. – С. 1036-1040.
- Shapiro A. D. et al. Prospective, randomised trial of two doses of rFVIIa (NovoSeven) in haemophilia patients with inhibitors undergoing surgery //Thrombosis and haemostasis. – 1998. – Т. 79. – №. 05. – С. 773-778.
- Achneck H. E. et al. A comprehensive review of topical hemostatic agents: efficacy and recommendations for use //Annals of surgery. – 2010. – Т. 251. – №. 2. – С. 217-228.
- McManus J. G., Wedmore I. Modern Hemostatic Agents for Hemorrhage Control â A Review and Discussion of Use in Current Combat Operations. – 2005.
- Okuma M. et al. Effects of etamsylate on platelet functions and arachidonic acid metabolism //Thrombosis and haemostasis. – 1982. – Т. 48. – №. 3. – С. 330-333.